|
|
Главная → СтатьиКоррозия металловРазрушение материала под действием внешней среды называют коррозией. Любая конструкция, в том числе и сварная, подвергается действию окружающей среды (воздух, вода, производственные газы, блуждающие токи). Действие среды может быть агрессивным или малоагрессивным. В первом случае конструкция может служить несколько лет или даже месяцев, а во втором— десятилетиями и даже столетиями. Коррозия металлов может быть вызвана химическими и электрохимическими процессами. К химическим относятся процессы, протекающие при непосредственном химическом взаимодействии между металлом и агрессивной средой и не сопровождающиеся возникновением тока. Под электрохимическими понимают процессы, при которых разрушение металла сопровождается появлением электрического тока (процессы в воде, электролитах, влажных газах, расплавленных солях и щелочах). В зависимости от характера агрессивной среды электрохимическая коррозия может быть структурной (вследствие неоднородности металла по структуре), атмосферной, почвенной (на металл действует почва), кислотной, щелочной, биологической (протекает в подземных условиях при участии микроорганизмов), в водных растворах солей, коррозия блуждающими токами, контактная (при контакте двух разнородных металлов) . Особенно опасна межкристаллитная коррозия, характерная появлением трещин. Разрушение происходит по границам кристаллитов, что нарушает связь между ними и приводит к неожиданному разрушению, так как очень часто внешний вид изделия при межкристаллит-нои коррозии не изменяется. —- Коррозия — это процесс физико-химического разрушения металла под влиянием внешней среды. По характеру процесса различают химическую и электрохимическую коррозию. В первом случае процесс окисления металла происходит при непосредственном воздействии соприкасающейся с ним среды без появления электрического тока, а во втором случае коррозия протекает в электролитах и сопровождается появлением электрического тока. В зависимости от характера агрессивной среды электрохимическая коррозия может быть атмосферной, почвенной, структурной (вследствие неоднородности металла по структуре), биологической (протекает в подземных условиях при участии микроорганизмов), щелочной, кислотной, контактной (при контакте двух разнородных металлов), коррозией, вызванной блуждающими токами или водными растворами солей. Стойкость против коррозии зависит от химического состава, структуры, состояния поверхности, напряженного состояния металла, а также химического состава, концентрации, температуры и скорости перемещения агрессивной среды по поверхности изделия. Мерой коррозионной стойкости является скорость коррозии металла в данных условиях и среде, которая выражается глубиной коррозии в миллиметрах в год или в потере массы в граммах за час на 1 м2 поверхности металла. Коррозионная стойкость сварных соединений в различных средах и при разных температурах имеет исключительно большое значение, так как сварные соединения часто работают в условиях, способных вызвать коррозию. Наиболее опасной является межкристаллит-ная (структурная) коррозия — процесс физико-химического разрушения металла по границам кристаллитов под действием агрессивной среды, при котором эта среда проникает вглубь металла по границам кристаллитов, нарушая связь между ними. Межкристаллитной коррозии подвержены аустенитные нержавеющие, высокохромистые швы, а также швы ферритного, полуфер-ритного и мартенситного классов. —- Коррозия представляет собой разрушение металлов вследствие взаимодействия их с внешней (коррозионной) средой. Этот термин происходит от латинского слова коррозио — разъедание. Коррозия — страшный бич промышленности, строительства, транспорта. Значительная часть ежегодно производимого металла уходит на то, чтобы восстановить потери от коррозии. Металлы получают путем выделения их из природных устойчивых соединений, например оксидов. В процессе коррозии металл под действием окружающей среды снова стремится перейти в более устойчивое соединение. В частности, при коррозии стали часто возникают оксиды и гидроксиды железа, обладающие неплотной структурой и плохо связанные с основным металлом. В конечном итоге уменьшается площадь сечения изделий, снижается их прочность. В наиболее тяжелых случаях коррозия поражает изделия насквозь, и они разрушаются. Степень коррозионного поражения металлов и сплавов в основном зависит от следующих факторов: химического состава и структуры металла или сплава, химического состава внешней среды, температуры среды, напряженного состояния металла в конструкции. Коррозию классифицируют по геометрическому характеру разрушений и по характеру взаимодействия металла со средой. По геометрическому характеру коррозионных разрушений различают сплошную, местную, подповерхностную, межкристаллитную, избирательную коррозию. При сплошной коррозии металл разрушается равномерно по всей поверхности. Местная коррозия нарушает целостность металла на отдельных участках поверхности изделия и выражается в поражении поверхности точками, пятнами, язвами. Подповерхностная коррозия начинается в толще металла. Продукты такой коррозии, увеличиваясь в объеме, выходят на поверхность металла и вызывают местное разрушение изделия. Межкристаллитная коррозия протекает по границам зерен металла и резко ухудшает его механические свойства. Избирательная коррозия сводится к растворению отдельных структурных составляющих сплавов. По характеру взаимодействия со сре-д о й коррозия бывает химическая и электрохимическая. Химическая коррозия протекает в средах, не проводящих электрического тока, например в сухих газах, жидкостях органического происхождения— нефти, бензине, спирте и т. п. Наиболее интенсивно такая коррозия проявляется при повышенной температуре. В результате на поверхности деталей образуется оксидная пленка. Плотная пленка предохраняет внутренние слои изделия от окисления. Такие пленки получаются, в частности, при коррозии алюминия и меди. Рыхлая пленка не защищает металл от дальнейшего поражения. Процесс окисления усиливается под влиянием температуры. Так, скорость коррозии углеродистой стали в газах с температурой до 600 °С очень мала, при более высокой температуре проницаемость оксидной пленки резко возрастает. Это увеличивает толщину слоя окалины, которая, будучи слабо сцеплена с основным металлом, отпадает. Легированные стали допускают без заметного окисления нагрев до более высоких температур. Электрохимическая коррозия протекает в водных растворах электролитов — солей, кислот, щелочей. Это наиболее распространенный вид коррозии. Строительные металлические конструкции, большей частью работающие во влажном воздухе, подвержены в основном электрохимической коррозии, которая усиливается с ростом концентрации в воздухе углекислого и сернистого газов. Интенсивно корродируют конструкции, находящиеся в грунте, например трубопроводы. При электрохимической коррозии часть атомов из кристаллической решетки металла или сплава переходит в раствор электролита в виде ионов. В металле остается эквивалентное количество электронов. В результате металл заряжается отрицательно, а окружающий его раствор электролита — положительно. Возникает гальваническая пара, в которой частицы разрушающегося металла постепенно переходят в раствор. Процесс электрохимической коррозии зависит оу вида металла. Если гальваническая пара состоит из двух металлов, то растворяется металл, стоящий правее в ряду напряжений: золото, серебро, медь, свинец, олово, никель, железо, хром, цинк, марганец, титан, алюминий, магний. Таким образом, при контакте железа с цинком растворяется цинк, а железа с медью— железо. В паре металл — неметалл в электролите растворяется металл. Гальванические пары возникают также между мельчайшими зернами сплавов, если они различаются по химическому составу и физическим свойствам. В частности, входящие в состав стали феррит и цементит образуют гальваническую пару, в которой анодом будет феррит, катодом — цементит. Поэтому в процессе коррозии феррит растворяется (рис. 14). Электрохимическая коррозия стали в щелочной среде значительно замедляется. Это обстоятельство используют при изготовлении железобетона. В процессе твердения большинства цементов возникает щелочная среда, которая способствует образованию на поверхности стальной арматуры защитной пленки из нерастворимых соединений железа типа Fe(OH)3. Происходит так называемое пассивирование железа. Пленка предохраняет металл от коррозии. Поэтому в железобетонных конструкциях, находящихся в воздушной среде с относительной влажностью не более 60%, коррозии арматуры нет. С увеличением влажности среды возрастает и вероятность коррозии стальной арматуры. Отсюда вытекает обязательное требование — защищать ее в конструкциях слоем плотного бетона толщиной 15,..40 мм, мало проницаемого для водяных паров. В сильно агрессивных средах применяют дополнительные меры защиты стальной арматуры конструкций.
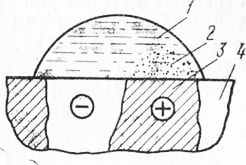
Рис. 14. Схема электрохимической коррозии стали: Защита от коррозии представляет собой конструктивные и профилактические меры, повышение коррозионной стойкости металлов, изоляцию их поверхности от воздействия среды, протекторную защиту. Конструктивные и профилактические меры заключаются в повышении качества обработки поверхности металлических изделий, а также в защите конструкций от атмосферных осадков. В ответственных деталях прибегают к полировке поверхностей. Благодаря этому сокращается реальная площадь поверхности металла, контактирующего со средой. Кроме того, с полированных поверхностей быстрее стекает влага. Для профилактики коррозии консервируют дорогостоящие машины и механизмы защитными смазочными материалами. Повышение коррозионной стойкости достигается введением в состав стали легирующих добавок— хрома, никеля, марганца, титана, меди. Весьма стойки к атмосферной коррозии нержавеющие легированные стали, содержащие в большом количестве хром, который создает на поверхности изделий плотную оксидную пленку. Эта пленка пассивирует сталь. Используемые в строительстве углеродистые и низколегированные стали иногда изготовляют с добавкой 0,2…0,5% меди, что повышает коррозионную стойкость в 1.5…3 раза. Изоляция поверхности металла от воздействия среды — наиболее распространенный Способ защиты строительных конструкций путем использования покрытий либо получения на поверхности металла защитной пленки. Неметаллические покрытия образуют на поверхности изделий защитную пленку, препятствующую проникновению влаги. Тем самым предотвращается возможность развития коррозии. В число неметаллических покрытий входят в основном лаки и краски. Используют битумные, дегтевые, синтетические лаки, а также масляные краски, алкид-ные и другие эмали. Санитарно-технические изделия— ванны, раковины, мойки—защищают неорганическими эмалями. Для этого на поверхность наносят тонкий слой смеси, состоящей из кварца, полевых шпатов, глины, буры. В процессе обжига при температуре 750…800°С образуется силикатный расплав, равномерно покрывающий поверхность изделия. Полученная эмаль отличается высокой прочностью, твердостью, коррозионной стойкостью. Нередко защитные покрытия выполняют из полимеров — полиэтилена, поливи-нилхлорида, полистирола, эпоксидных смол. Поверхности закладных деталей сборных железобетонных конструкций защищают с помощью цементно-поли-стирольных или цементно-перхлорвиниловых обмазок. Металлические покрытия получают нанесением на поверхность изделия тонкой пленки из другого металла. Различают покрытия анодные и катодные. Анодные покрытия выполняют из металла, стоящего в ряду напряжений правее защищаемого металла. Для стальных изделий анодной защитой служит пленка из цинка, алюминия. Если покрытие окажется нарушенным, то разрушается покрывающий, а не основной металл. Цинковые и алюминиевые покрытия часто применяют для защиты поверхности закладных деталей в железобетонных сборных конструкциях. Катодные покрытия предохраняют металл от прямого контакта с коррозионной средой. Катодную защиту выполняют из олова, свинца, никеля. Такая защита работоспособна до тех пор, пока не нарушена целостность покрытия. При местном нарушении защитной пленки начнется коррозия стали. Защитные пленки формируют путем целенаправленной обработки деталей специальными химическими реагентами. После такой обработки на поверхности металла образуются соединения с большой коррозионной стойкостью. Защитные пленки создают, например, путем оксидирования, обрабатывая детали в горячем водном растворе сильных окислителей — едкого натра, селитры и перекиси марганца. Плотная и прочная пленка черного цвета на поверхности стали, состоящая в основном из магнитного оксида железа, предохраняет металл от дальнейшего окисления. Иногда прибегают к фосфатированию стали, обрабатывая изделия растворами фосфорной кислоты и ее солей. Получаемая пленка серого цвета надежно защищает металл от коррозии как на воздухе, так и в пресной воде. Протекторная защита заключается в соединении металла защищаемой конструкции с металлом, который находится правее в ряду напряжений. В образованной таким путем гальванической паре металл протектора служит анодом. Он и будет постепенно разрушаться, а основной металл останется целым. Данный способ применяют для защиты конструкций в морской воде, влажных грунтах. Стальные конструкции опор ЛЭП, электроконтактной сети, трубопроводов снабжают протекторами в виде пластин из цинка, алюминиево-цинковых или магниевых сплавов. Читать далее: Сварочные флюсы Сварочные электроды Общие сведения о сварке арматуры Противопожарные мероприятия при сварке Безопасность труда при сварке технологических трубопроводов Безопасность труда при сварке строительных металлических и железобетонных конструкций Защита от поражения электрическим током при сварке Техника безопасности и производственная санитария при сварке Управление качеством сварки Статистический метод контроля Ваш отзыв |
|
|
|
|
© 2007 "Строй-сервер.ру". - информационная система по ремонту и строительству. |
|